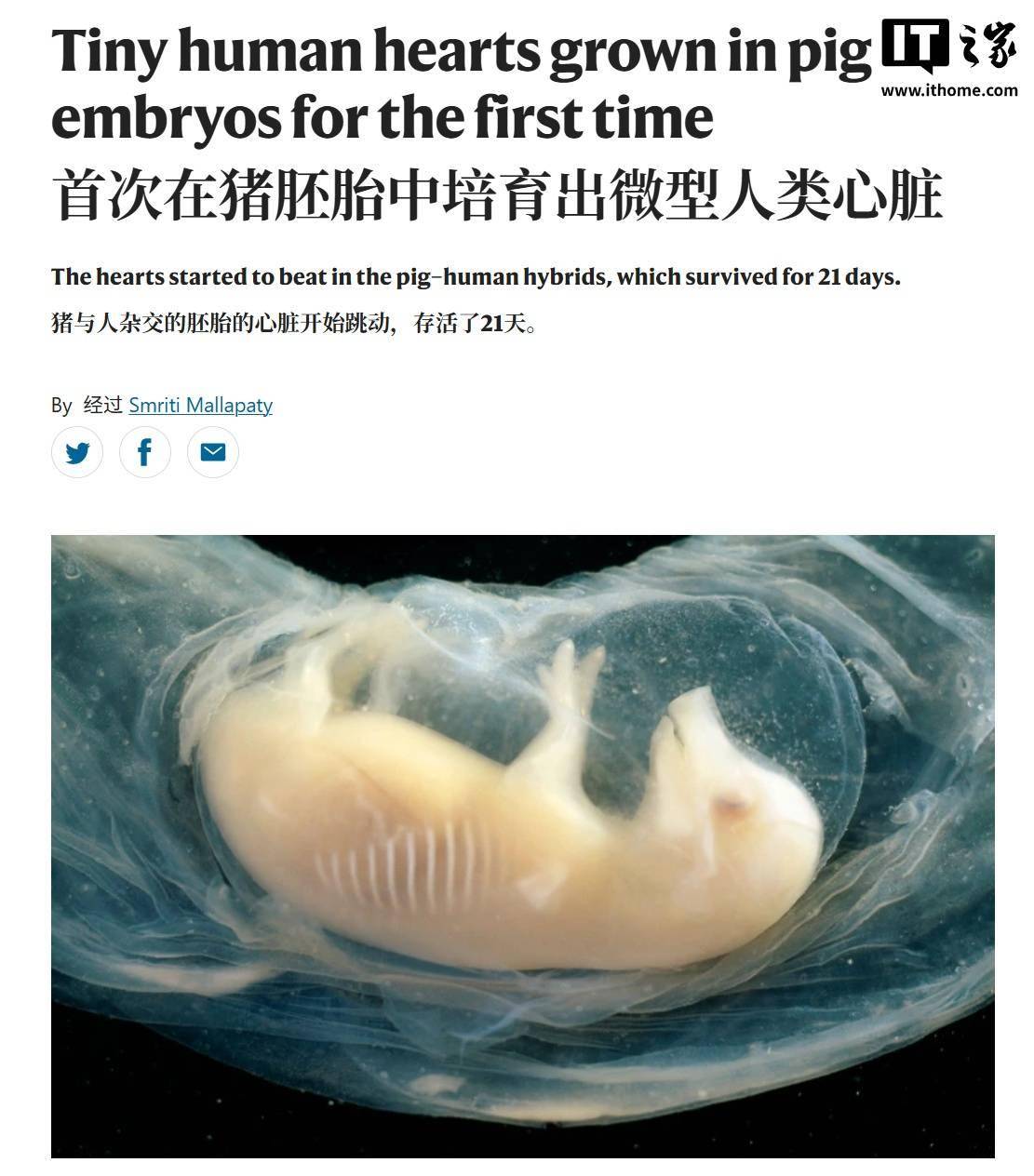
据研究团队介绍,该实验通过人-动物嵌合体技术,旨在解决全球范围内日益严重的器官短缺问题。研究人员利用基因编辑技术,精准敲除了猪胚胎中两个关键的心脏发育基因,随后在桑椹胚阶段(此时胚胎由约十几个快速分裂的细胞组成球体),向胚胎中注入经过基因增强的人类干细胞。这些干细胞经过改造,显著提高了在猪体内的存活率。胚胎移植至代孕母猪体内后,最长存活期达到 21 天,心脏发育至人类胚胎同阶段的大小(约指尖大小)并开始跳动。通过荧光标记技术,研究人员确认了人类细胞的存在,但具体占比尚未公布。此前,该团队在猪胚胎中培育的人类肾脏组织中,人类细胞占比曾达到 40%-60%。
尽管这一成果标志着人-动物嵌合体技术在器官培育领域迈出了重要一步,但研究仍面临诸多挑战。美国斯坦福大学的专家指出,需要进一步验证心脏细胞是否完全为人类来源,以避免物种间细胞污染。日本东京科学研究所的学者也强调,目前荧光标记的人类细胞仅分布在心脏局部区域,其与猪细胞的整合程度尚不明确。未来,若要将此类器官应用于临床移植,必须确保其完全由人类细胞构成,以避免免疫排斥反应。
IT之家注意到,该研究目前尚未经过同行评审,但其为异种器官移植领域带来了新的希望。猪因其器官大小和结构与人类高度相似,被视为理想的供体来源。如果这一技术能够进一步成熟,有望成为解决全球器官短缺问题的突破性方案。



 微信扫一扫打赏
微信扫一扫打赏
 支付宝扫一扫打赏
支付宝扫一扫打赏






